
|
阶段 |
服务内容 |
时间预估 |
|
咨询阶段 |
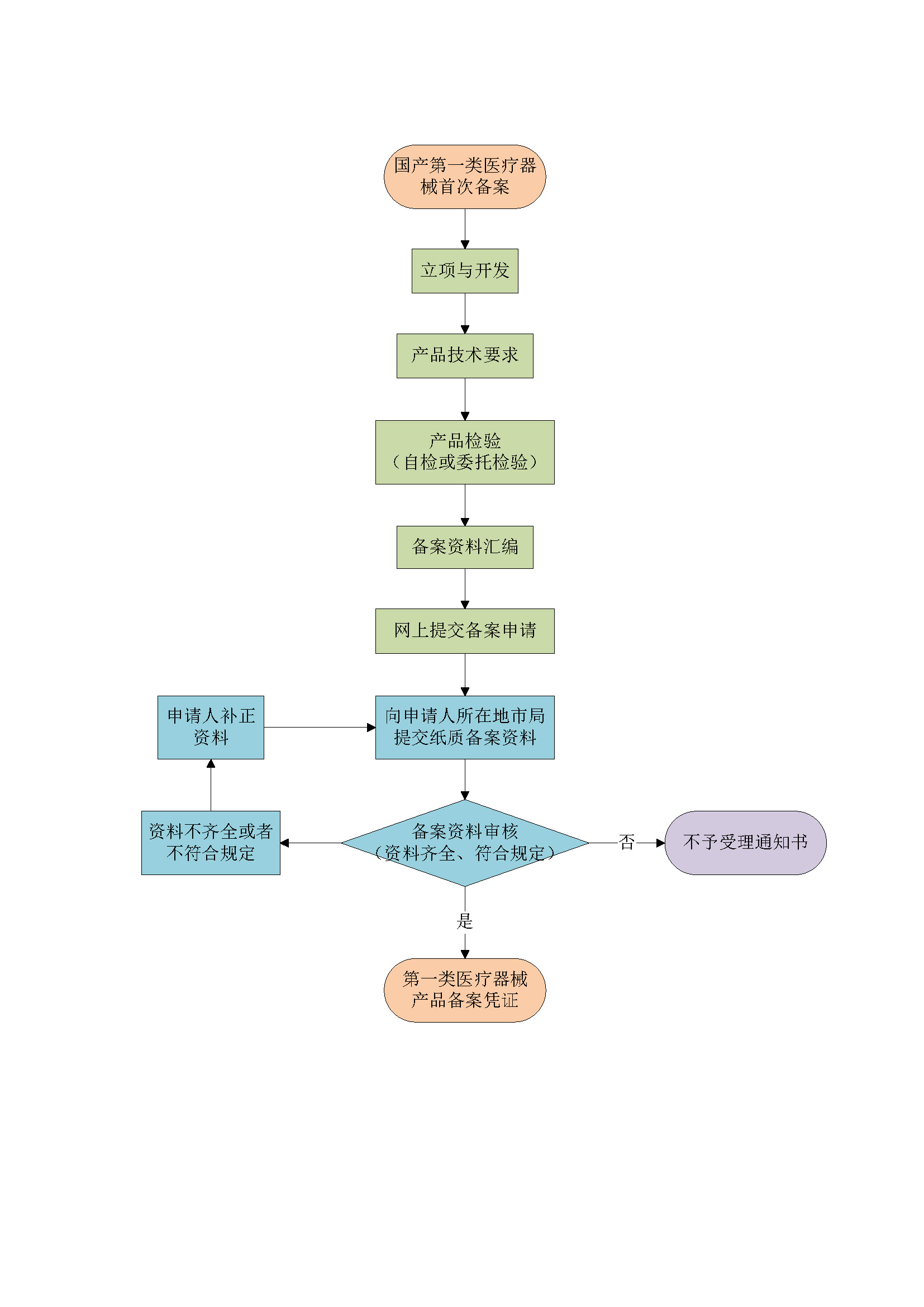
免费提供法规和产品咨询,了解客户需求,提供咨询服务方案及报价,产品可行性分析报告(根据客户需求)。 |
5个工作日 |
|
立项阶段 |
确定客户需求,签订合同,成立项目组,制定备案整体方案及计划,项目组启动立项。 |
15个工作日 |
|
备案资料准备 |
按照客户的实际需求,指导并协助客户编写产品质量管理体系文件、编写产品备案资料。 |
视产品情况而定 |
|
备案申请 |
当场备案,拿到备案凭证 |
1个工作日 |
无官方费用。
咨询电话:020-32643645 18028674076
地址1:广州市生物岛寰宇三路36号官洲生命科学创新中心B栋411-412单元
地址2:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区F911室-F919室

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室