发布时间:2022-10-24
小核酸药物又称RNAi(RNA interference)技术药物,为分子量较小的单链或双链RNA,其组成一般小于100个核苷酸,可以治疗因蛋白水平异常而引起的各类疾病,其作用机制为下调或上调基因表达,比如与靶标mRNA结合从而阻止其翻译,下调基因表达;参与mRNA剪接,上调目标基因表达等。
RNAi技术的研究曾于2006年获诺贝尔生理医学奖,堪称人类科学史上的重大发现和技术革新。RNAi疗法在近年内取得多项突破性成果,已成为全球投资新风口和生物制药巨头的兵家必争之地。RNAi是指长链双RNA(dsRNA)被剪切为siRNA后,与蛋白质结合形成siRNA诱导干扰复合体(RISC),RISC再与互补的mRNA结合,使靶基因mRNA降解,最终沉默特定基因表达。狭义的小核酸是指介导RNAi的短双链RNA片段(siRNA),广义的小核酸范围则涵盖了siRNA、miRNA和反义核酸等。
相比于抗体和小分子药物,小核酸药物具有先天的优势,使其有望为现代生物医药产业开辟一个全新的开发方向,进一步填补现有疗法的治疗空白,并且具备治愈疾病的潜力。小核酸药物的先天优势如下:
研发周期短,药物靶点筛选快
候选靶点丰富
治疗领域更广
不易产生耐药性
由于抗体和小分子主要通过调节细胞信号通路和代谢等方式发挥治疗作用,因此可能会由于补偿通 路上调或抗原表达下降等因素产生耐药性,而小核酸药物直接调节上游基因表达,因此相对不易产生耐药性。
效果持久
研发成功率较高
研发成功率较高
与传统的小分子药物、抗体药物和基因治疗药物相比,小核酸药物的优势也是十分明显。小核酸药物与小分子药物、抗体和基因治疗药物各自特点如下表:
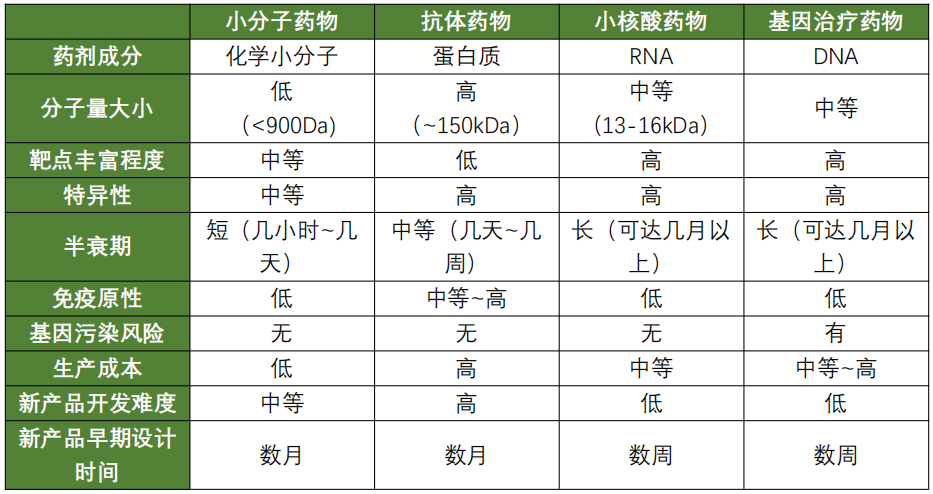
这些独特的优势,让小核酸药物有望成为继小分子和抗体药物之后的第三次浪潮。
反义寡核苷酸(ASO)药物
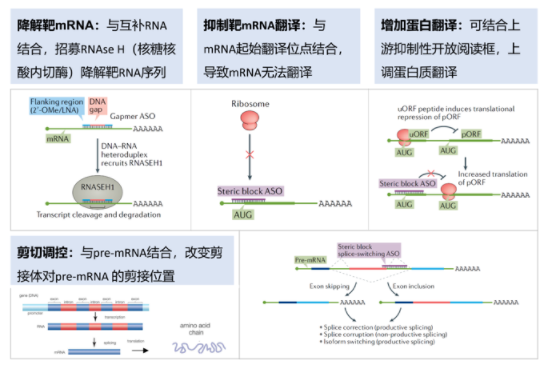
ASO作用机制(图片来源:网络)
小干扰RNA(siRNA)药物
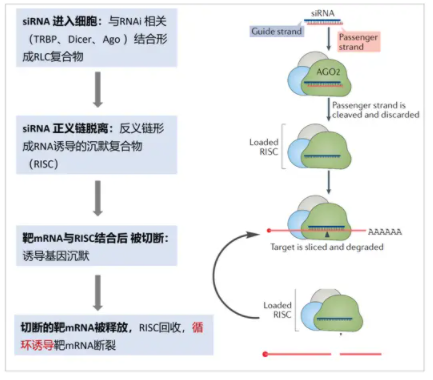
SiRNA作用机制(图片来源:网络)
RNA激活(saRNA)药物
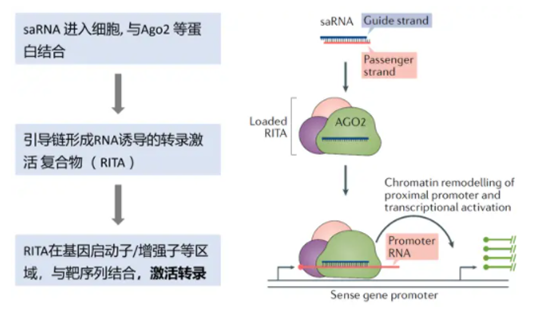
saRNA作用机制(图片来源:网络)
适配体(aptamer)药物
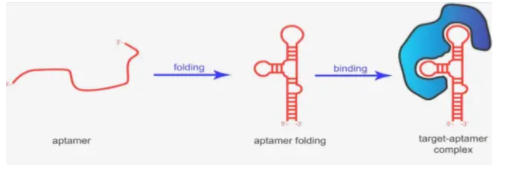
Aptamer作用机制(图片来源:网络)
探索期
早于1978年哈佛大学科学家Paul Zamecnik 等人首次报道了反义寡核苷酸(antisense oligodeoxynucleotides)可抑制肉瘤病毒的复制。1998年,FDA批准了第一个反义寡核苷酸(ASO)药物Fomivirsen,此后这类药物研发获得广泛关注。1998年,Andrew Fire和Craig Mello在线虫中首次揭示了RNAi现象,并凭借这一发现于2006年获得了诺贝尔生理学与医学奖。2001年,RNAi技术被Science杂志评为2001年的十大科学进展之一。
震荡发展期
2004年,OPKO公司用于老年性黄斑变病的第一个siRNA药物Bevasiranib进入临床试验,小核酸药物领域迎来蓬勃发展期。但由于小核酸技术领域的技术瓶颈迟迟没有获得突破,药物本身的特性以及商业化进程中的种种问题,多款药物在临床研究中失败,并宣布终止开发,多家大药企放弃并出售小核酸开发的平台,如2003年Fomivirsen因销售额过低退市,随后3个ASO药物III期临床接连失败,行业发展一度陷入低谷,小核酸的成药性也被质疑。其中,小核酸药物发展失败原因主要为:小核酸在体内易被核酸酶降解、具有免疫原性等缺点而容易被人体清除,导致有效性和安全性不足。
快速发展期
2013年后,随着以Alnylam为代表的企业研发出新的化学修饰技术和GalNAc递送技术等,小核酸药物的研发迎来新的转机。其后于2016年,Sarepta Therapeutics 和Ionis 研发的 2 款 ASO药物先后被FDA批准上市。2018年, 全球首款 siRNA 药物即 Alnylam 公司的 Onpattro 由FDA批准上市,用于由hATTR引起的多发性神经病患者的治疗。直至目前,全球有超过 20 余款siRNA药物,50余款ASO药物处于临床研究阶段,治疗领域覆盖中枢神经系统、心血管、抗感染和抗肿瘤等,小核酸药物逐渐成为近年来新药研发关注的热点之一。
小核酸药物发展历程(图片来源:网络)
【文案来源】庞工
【全文整理】SCPRS
【声明】部分文章和信息来源于互联网。不代表本订阅号赞同其观点,以及我们不对文中所包含内容准确性、可靠性或完整性作任何保证。若转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施。

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室