发布时间:2022-07-01
2022年6月23日国家药品监督管理局正式发布《支持港澳药品上市许可持有人在大湾区内地9市生产药品实施方案》和《支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案》的通知。
《支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案》
概要 :
小贴士:
大湾区内地9市包括:广州、佛山、肇庆、深圳、东莞、惠州、珠海、中山、江门
职责分工:
|
国家药监局 |
对港澳医疗器械注册证变更实施审批 |
|
广东省药监局 |
1.港澳医疗器械注册人跨境委托生产涉及的医疗器械生产许可工作 2.组织开展医疗器械注册质量管理体系核查 3.落实属地监管责任 4. 加强对辖区内相关企业的监督检查 |
(一) 品种范围:医疗器械应同时满足以下三个条件:
1.由在香港或澳门合法登记的企业所持有和生产
2.已获得《医疗器械注册证》在境内注册上市
3.非《禁止委托生产医疗器械目录》(国家药监局通告2022年第17号)规定的品种
(二)适用企业:医疗器械注册人为港澳企业的,由其在大湾区内地设立的外商投资企业法人作为代理人,办理医疗器械变更注册事项,协助港澳医疗器械注册人履行义务,承担连带责任。
港澳医疗器械注册人获得国家药监局发放的医疗器械注册证后,可以委托大湾区内地9市符合条件的企业生产。受托生产企业应当具备与所生产医疗器械相适应的质量管理体系和生产能力。
1.确定境内代理人
2.签署委托生产协议(参考国家药监局制定的医疗器械委托生产质量协议指南要求)
3. 变更医疗器械注册证生产地址
4.受托生产企业履行报告义务
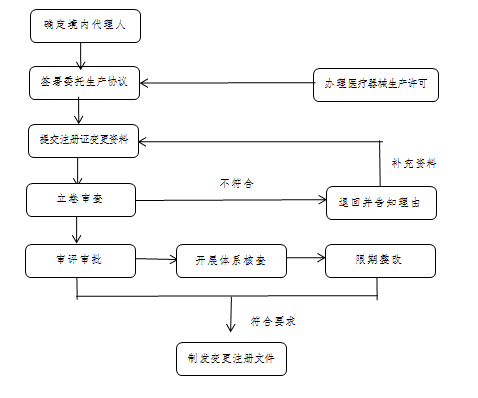
申报资料:
按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家药监局公告2021年第121号)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家药监局公告2021年第122号)有关要求提交变更注册申报资料。
广州华南新药注册申报服务有限公司能为您提供全面、优质的注册申报服务,详情可扫描下方微信公众号二维码进入工具栏进行了解。拨打电话18027296587进行业务咨询。

工作要求:
1.委托生产的医疗器械其主要原材料和生产工艺不应发生改变,产品在境内生产的质量管理体系应当与境外生产质量管理体系具有等同性。
2.港澳医疗器械注册人、代理人应当每年对质量管理体系的运行情况进行自查,并于次年3月31日前通过省药监局网上平台提交自查报告。
其他事项:
港澳医疗器械注册人解除跨境委托生产的,原受托生产企业应当在30日内向广东省药监局报告。

邮箱:scprs@sccip.org.cn
电话:020-32643642 18027296587
地址:广州市黄埔区科学城揽月路3号广州国际企业孵化器F区720室、广州市黄埔区科学城揽月路3号广州国际企业孵化器F区911室-F919室